EVALUACION INICIAL DEL PACIENTE PEDIATRICO
La permeabilidad y estabilidad de la vía aérea deben ser las prioridades absolutas en todo paciente, ya que su fallo puede ser amenazante para la vida de forma muy rápida.
Manejo: La apertura de la vía aérea con colocación de la cabeza en posición neutra y la maniobra frente- mentón o tracción mandibular (siempre esta última en caso de traumatismo) es fundamen- tal y lo primero a realizar.
Va a ser muy frecuente la necesidad de aspiración (de secreciones, sangre o cuerpos extraños) y colocar al paciente sentado o semiincorporado.
En caso de que la vía aérea no sea permeable con las maniobras descritas hay que valorar el manejo instrumental de la vía aérea, con cánulas oro- faríngeas o nasofaríngeas o intubación traqueal.
Además del patrón y ruidos respiratorios au- dibles, y la auscultación en línea axilar media, disponemos de distintos parámetros:
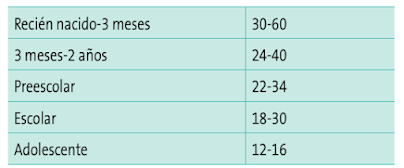
- Frecuencia respiratoria. Olvidada con demasia- da frecuencia en la evaluación pediátrica, ya que se altera con gran facilidad. Hay que tener en cuenta los valores normales para la edad y que puede alterarse con la fiebre, la ansiedad o el dolor.
- Saturación de oxígeno. Es una medida no inva- siva que da idea de la oxigenación del paciente, pero no se correlaciona de forma directa con el grado de dificultad respiratoria, ya que la oxigenación puede mantenerse con aumento del trabajo respiratorio basal. Puede dar una lectura alterada en caso de movimientos del paciente o mala perfusión periférica. En un paciente con metahemoglobinemia o intoxicado por monóxido de carbono la saturación es de valor normal, incluso con intoxicaciones graves. En este último caso deberemos usar cooxímetros no invasivos como método de screening inicial, y la cooximetría en sangre venosa o arterial para confirmarlo.
- Medición de CO2. Cada vez están más extendidas la capnometría y capnografía en aire espirado, con dispositivos adaptados para el paciente intubado o con respiración espontánea. Tiene una gran correlación con la ventilación del paciente en situaciones muy variadas (con aumento en la hipoventilación y con disminución o valores normal en la alteración de la relación ventilación/perfusión). Existen dispositivos de medición transcutánea de CO2, de menor uso en las emergencias, ya que pueden ser difíciles de calibrar.
- Gasometría. Nos puede servir para valorar la ventilación y además la perfusión. Se puede obtener una muestra venosa al canalizar la vía periférica (una muestra arterial ofrece pocos beneficios frente a los riesgos en la situación urgente). Lo ideal es disponer de un gasómetro accesible desde la sala de emergencias.
C. Circulación
En este apartado se valora de distintas formas las perfusiones tisulares central y periférica, además de los ya explicados con el TEP. No hay un parámetro único que pueda valorar el pa- ciente con shock, y deberá ser una conjunción de todos.
Frecuencia cardiaca (FC). La taquicardia puede ser un signo de hipoxia o hipoperfusión tisular, o la bradicardia (< 60 lpm en niños o menor de < 100 en neonatos) un signo de estado crítico. Como la frecuencia cardiaca puede alterarse con la fiebre, el dolor o la ansiedad, en la Ta- bla 4 vemos los valores normales de FC para los distintos rangos de edad.
· Se palpan pulsos periféricos: TAS >90 mmHg.
· Se palpan pulsos centrales: TAS >50 mmHg.
· Ausencia de pulsos: TAS <50 mmHg.
· Relleno capilar. El tiempo de relleno cutáneo capilar tras compresión debe ser menor de 2-3 segundos. El límite concreto no está claro y la forma de medirlo puede ser muy inexacta, por tanto, es un signo exploratorio que hay que valorar en el contexto del TEP y otros signos de shock. Podremos comprobarlo en la rótula, manos, pies o antebrazo.
· Nivel térmico. La frialdad en zonas acras como manos y pies, especialmente en recién nacidos y lactantes, puede ser normal, pero la zona de transición de temperatura se hará más proxi- mal a los tobillos y muñecas si la perfusión está alterada.
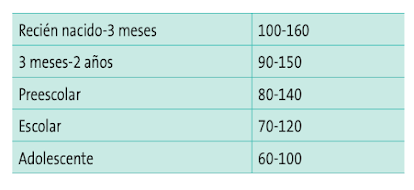
· Presión arterial. Todo paciente inestable debe tener registrado este parámetro, pero debemos tener en cuenta la dificultad en su obtención y valoración. Es importante usar un manguito de tamaño adecuado al paciente y el llanto o el movimiento pueden alterar la medición. Recordemos que la hipotensión arterial es un signo tardío de afectación hemo- dinámica y una PA normal puede aparecer en un niño con shock compensado. En la Tabla 5 se listan lo valores normales de TAS para cada edad. También se puede calcular una TAS aceptable mediante la fórmula TAS = 70 + (2 × edad en años).
· Para la evaluación inicial no será necesario un electrocardiograma (ECG) de 12 derivaciones, con el ECG del monitor cardiaco será suficiente.
D. Neurológico
Las alteraciones del sistema nervioso central (SNC) pueden producirse por una alteración neurológica primaria, o de forma secundaria a una alteración respiratoria o circulatoria. Por tanto, una alteración neurológica también debe ser evaluada con monitorización respiratoria y cardiaca (FC, FR, PA, saturación, glucemia y capnografía). No existe ninguna escala validada que nos pueda servir como valoración rápida del nivel de consciencia, sino que debe- remos valorar de forma conjunta la alteración de los elementos neurológicos del TEP con los aquí citados.
Evaluación:
· Escala AVPU. Valora de forma rápida el nivel de consciencia y la respuesta a estímulos. El paciente puede estar alerta (A), responder a estímulos verbales (V), responder a estímulos dolorosos (P: Pain), o no responder (U: Unres- ponsive). Esta escala y el TEP nos sirven para valorar la actividad cortical.
· Escala de Glasgow (Glasgow Coma Scale o GCS). Validada para niños que han sufrido un traumatismo craneal, es de uso menos frecuente que la escala AVPU, ya que requiere más tiempo en su valoración y esta puede ser difícil. Se puede aproximar la escala AVPU a la GCS de la siguiente manera: A = GCS 15, V = GCS 13, P = GCS 8, U = GCS 3.
· Glucemia capilar. Debe ser un valor que hay que incorporar dentro de los signos vitales monitorizados, especialmente en los pacientes con alteración neurológica.
· Pupilas. Siempre debemos evaluar la respuesta pupilar a la luz, que valora la respuesta del tronco encefálico y puede alterarse en muchas situaciones como intoxicaciones, hipoxia, convulsión o herniación cerebral.
· Actividad motora. Podemos hacer de forma rápida una evaluación de la postura, el tono muscular, la movilidad de las extremidades y los movimientos anormales (como convulsiones o mioclonías).
· Evaluación del dolor. Debemos valorar la existencia e intensidad del dolor mediante escalas específicas. Hemos de tener en cuenta que la valoración neurológica se ve alterada si usamos fármacos sedantes o paralizantes.
E. Exposición
Como último punto se debe descubrir completamente al niño para valorar la piel, el abdomen, las extremidades y cualquier anomalía anatómica. Al terminar la valoración de este punto no podemos olvidarnos de tapar al niño para evitar que se enfríe. Son recomendables el uso de oxígeno calentado y humidificado, y de sueros calentados.
La hipotermia activa tras una situación de PCR es un punto contro- vertido y la evidencia en niños es aún limitada. Puede considerarse en niños con posparada cardiaca o arritmias ventriculares graves y coma persistente. En todo caso debemos tra tar la fiebre y la hipertermia, esta última de forma agresiva.
Como parte de la evaluación primaria, se puede incorporar, si se dispone de ella, la ecografía a pie de cama, particularmente la eco-FAST en los pacientes traumatizados. Además, puede ser de utilidad en la canalización de vías.
EVALUACIÓN SECUNDARIA
Tras realizar la evaluación general y la estabilización inicial podemos pasar a la anamnesis y exploración física detalladas. Con mucha frecuencia este punto se lleva a cabo cuando no se ha completado el TEP, ABCDE y las actuaciones necesarias, retrasando la atención inmediata al niño. El objetivo será obtener una historia clínica del episodio actual, una exploración física dirigida y un enfoque diagnóstico inicial.
Anamnesis. Para recordar los elementos básicos de la historia clínica inicial podemos usar la regla nemotécnica SAMPLE:
· Signos y síntomas: descripción de las características de cada uno de ellos.
· Alergias: medicamentosas o de otro tipo.
· Medicaciones: tratamientos habituales y fármacos que toma para el proceso actual o ha tomado recientemente.
· Patologías previas: cualquiera que pueda ser de interés para el proceso actual. En este punto incluimos la vacunación.
· Última ingesta (last oral intake): hora aproximada de la última ingesta sólida o líquida.
· Eventos: que hayan podido conducir a su estado actual.
La exploración física será dirigida según los síntomas y signos presentes, y deberá ser sistemática, de pies a cabeza, o de la cabeza a los pies. Por ejemplo: piel y aspecto general, extremidades, abdomen y genitourinario, tórax, cuello, cabeza y región ORL. Completamos con una exploración neurológica que incluya pares craneales, tono, postura, fuerza, reflejos y signos cerebelosos, siempre adaptado a la edad y condición del paciente.
ESTIMACIÓN DEL PESO
Necesitaremos un peso aproximado del paciente para calcular de forma adecuada las dosis de los fármacos y el tamaño del mate- rial. La mejor información la podemos obtener de un familiar del paciente, o si no se encuentra ninguno de una cinta de Broselow (o similares) que nos darán una estimación del peso según la altura. Existe una fórmula, menos exacta, para estimar el peso en niño de 1 a 10 años: peso(kg) = 2 × (edad en años + 4).
PRESENCIA PARENTAL
Existe abundante evidencia y experiencia de que la presencia de los padres o cuidadores durante la estabilización del niño grave y la realización de procedimientos de todo tipo mejora el dolor y la ansiedad del paciente y de su familia, siempre que no dificulten la atención al niño. En caso de que el pronóstico sea muy malo o se produzca la muerte su presencia puede ayudar mucho en este proceso. No se ha reportado que la presencia de la familia sea perjudicial en el desarrollo de las maniobras de estabilización. Incluso debe permitirse contacto físico con el paciente, si es posible. Sería deseable que un miembro del equipo se ocupe de informar con frecuencia a la familia sobre el proceso.
TRANSPORTE DE PACIENTE PEDIATRICO
El objetivo de transporte pediatrico es ofrecer la calidad de cuidados oportuna hasta la llegada del niño enfermo a la UCI. Este proceso comienza con la consulta inmediata por radio o telefono desde el primer momento y mientras estan movilizando vehiculos.
La fase inicial de estabilización y preparación previa al transporte tiene una importancia igual o superior al propio traslado. El éxito o la ausencia de incidencia de incidencias durante el traslado depende en gran medida de dicha fase de esatabilización. A su vez, hay que tener en cuenta la complejidad técnica del medio de transporte. Habitualmente es un habitaculo reducido (ambulancia, helicóptero, avión), un medio movil y ruidoso que confiere poca estabilidad a la hora de trabajar.
Farah MM, Khoon-Yen T, Lavelle J. A general approach to ill and injured children. En: Bachur RG, Shaw KN (eds.). Textbook of Pedia- tric Emergency Medicine. 7.a ed. Filadelfia: Lippincott Williams & Wilkins; 2015. p. 1-19.
- Velasco Zuñiga, R. Triángulo de evaluación pediátrica. Pediatr Integral. 2014;18(5):320-3.
- Edge WE, Kanter RK, et al. Reduction of morbibdity in intrahospital transport by specialized pediatric staff. Crit Care Med. 199: 221.186-1.191.